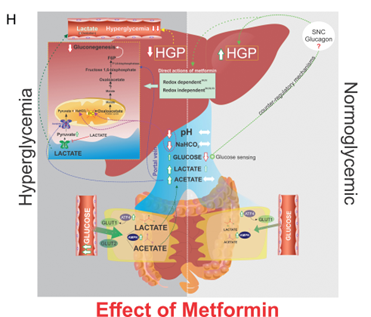
O local e os mecanismos de ação da metformina não são completamente compreendidos. Mostramos que, sob condições hiperglicêmicas, a metformina aumenta a captação intestinal basolateral de glicose (BIGU). Seus metabólitos, produzidos no intestino, chegam ao fígado pela veia porta e reduzem a produção hepática de glicose (HGP). Em condições normoglicêmicas, a metformina aumenta modestamente o BIGU, induzindo hipoglicemia na veia porta, sem aumentar a HGP em resposta. Embora nossos dados não excluam uma ação direta da metformina no fígado, indicam que o primeiro local de ação é o intestino. Através da comunicação entre intestino, veia porta e fígado, a metformina pode desempenhar um papel no controle da HGP, integrando seus locais e mecanismos de ação.
https://www.pnas.org/doi/abs/10.1073/pnas.2211933120
Autor: Natália N. Tobar